難病の治療に期待がかかるゲノム編集
動物や植物など生物の設計図とも言えるゲノムを書き換える「ゲノム編集」が注目されている。農産物や畜産物などの品種改良に加え、人間の遺伝子の異常で発症する難病を治療する「ゲノム医療」が可能になると期待されている。
 東京大学 大学院理学系研究科 生物科学専攻 教授 濡木 理氏
東京大学 大学院理学系研究科 生物科学専攻 教授 濡木 理氏
東京大学 大学院理学系研究科 生物科学専攻 教授の濡木理氏は、X線やクライオ電顕によるタンパク質や核酸の立体構造解析において世界をリードする存在だ。2012年には、立体構造解析がきわめて難しい膜タンパク質「チャネルロドプシン 」の解析に成功、同論文はネイチャー誌の表紙に採用された。2014年にはさらに、ゲノム医療への応用が期待される「CRISPR-Cas9(クリスパー・キャスナイン)」の立体構造を明らかにした。
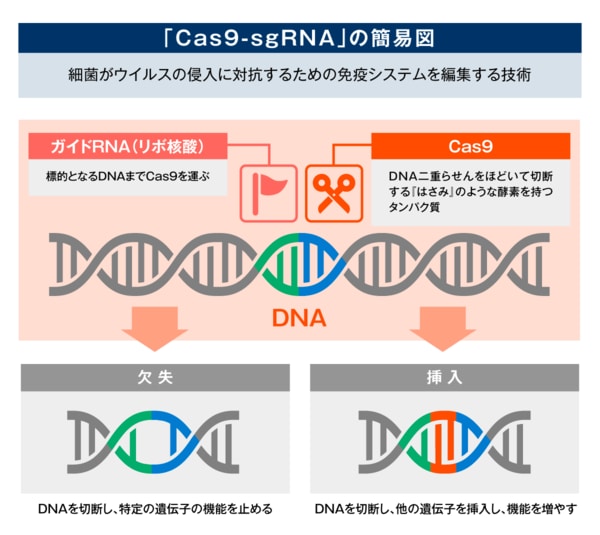
濡木氏は次のように説明する。「Cas9は、DNA(デオキシリボ核酸)の二重らせんをほどいて切断する『はさみ』のような酵素を持つタンパク質です。ガイドRNA(リボ核酸)が標的となるDNAまでCas9を運び切断します。DNAは末端が不安定なため、修復酵素が働いてこれが修復されます。その際に、DNAの塩基* のinsertion(挿入)やdeletion(欠失)など、DNA配列の改変が起こります。このような現象を利用して、標的となる遺伝子のノックアウト(破壊)ができるわけです」
*アデニン(A)・チミン(T)・グアニン(G)・シトシン(C)を指す
免疫タンパク質のCas9のコンポーネントは共通だ。すなわちはさみは一つだが、ガイドRNAを新たに設計すれば、さまざまな遺伝子のノックアウトが可能だという。
「実際にゲノム編集による臨床試験も始まっています。例えば『鎌状赤血球症』および『βサラセミア』は、いずれも特定の遺伝子の突然変異によってヘモグロビンの生産量が低下することによって起こります。『鎌状赤血球症』は、重度の貧血が起こり、発症の多いアフリカでは20歳になる前に亡くなってしまうこともある難病です。そこで、ゲノム編集により、ヘモグロビンの生産を増加させることで、これらの治療につながると期待されています」
具体的には、胎児性ヘモグロビンを生産する遺伝子を発現させることでそれを可能にするという。人間は胎児のときに胎児性ヘモグロビンが働いているが、大人になると生産をやめてしまうが、ゲノム編集により、その働きを再び呼び起こすのだ。
ゲノム編集が直面する課題とは
ゲノム医療の実現のためにも期待の高まるゲノム編集だが、いくつかの課題もあるという。濡木氏は次のように話す。「まず、Cas9のサイズが大きすぎるということです。よく使われる化膿レンサ球菌のCas9(SPCas9)は、1368残基あり、DNA数は4.1Kbもあります。アデノ随伴ウイルスベクター(AAV)の場合、外から入れることのできる遺伝子の大きさは約4.5Kbなので、なかなかベクターに載せることができません。細胞への導入効率がよくないのです。私たちはそこで、マサチューセッツ工科大学・ブロード研究所のフェン・チャン博士と共同研究で、黄色ブドウ球菌の持つCas9(SaCas9)の分子構造を決定し、ゲノム編集ツールとして働く仕組みを原子レベルで解明しました。SaCas9は1053残基で、SPCas9よりも300残基以上短く、DNA数も1Kbほど短くなりました」
これなら、比較的容易にウイルスベクターに載せることができるわけだ。ちなみに、濡木氏とも親しい間柄のチャン博士は世界で初めてヒトの細胞をゲノム編集した成果で知られ、CRISPR-Cas9の基本特許も取得している。
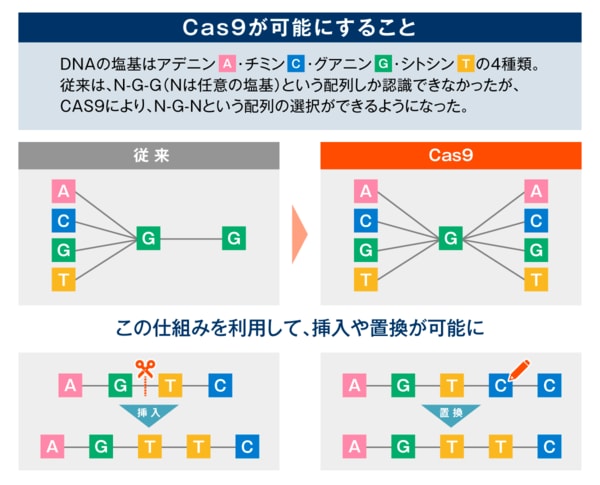
「Cas9の2つ目の課題は、『Cas9はDNAのはさみ』とは言っても、どこでも切れるわけでないということです。それは、Cas9がPAM配列を認識して切断しているからです」
DNAは4つの塩基(A、C、G、T)から成る。SPCas9はPAM(protospacer adjacent motif)と呼ばれる塩基配列のうち「NGG(Nは任意の塩基)」のPAM配列を認識する。
「ゲノム編集を行うためには、標的となる配列の20塩基上流にPAM配列がなければなりません。ところがNGGという配列しか認識しないため、標的にできる確率が低かったのです。であれば、NGGではなくNGをPAMとして認識するCas9を開発できないかと考えました」
濡木氏らは、SPCas9にアミノ酸変異を導入することにより、NGGに加え、NGA、NGT、NGCをPAMとして認識するCas9改変体(Cas9-NG)の開発に成功したという。NG、すなわちGが1文字のPAM配列も認識できるCas9ができた。より多くのゲノム編集ができる有用なツールが誕生したわけだ。
「切らない」ゲノム編集でオフターゲットの問題を解決
「ゲノム編集の3つ目の課題はオフターゲット(off target)の問題です」と濡木氏は語る。
オフターゲットとは、Cas9がDNAを切断する際に、本来標的としていない類似の配列まで誤って切断してしまうことだ。細胞ががん化するなど、意図しない突然変異が起きる可能性もある。
「そこで私たちが研究開発を進めているのが『切らない』ゲノム編集です。Cas9はRNAの力によってゲノムの特定の配列を認識し、両方で挟んで切断します。その両方、または片方のはさみを働かなくしようというのが『切らない』ゲノム編集です。具体的には、触媒部位を変えたCas9の変異体の後ろに脱アミノ化酵素を付けることで、ゲノム編集する位置から17~19塩基上流、3塩基から5塩基の中のCをTに変えたり、AをGに変えたりすることができます」と濡木氏は説明する。まさに、切らずして塩基置換ができるわけだ。
実用化に向けた取り組みも進んでいる。株式会社モダリス(旧:エディジーン株式会社、東京・中央、森田晴彦最高経営責任者)は、独自のゲノム編集技術による創薬を目指す東大関連ベンチャーで、濡木氏が開発した生体分子の立体構造の解析技術を応用し、Cas9の小型化、「切らない」ゲノム編集などのプラットフォームを「CRISPR-GNDM(Guide Nucleotide Directed Modulation)」として提供し、新しい遺伝子治療薬の開発を進めている。同社は濡木氏も社外取締役を務めているほか、東京大学の投資事業会社である東京大学協創プラットフォーム開発も出資を行っている。
「日本発」のゲノム医療の実現に向けて期待が高まる
ゲノム編集への関心が世界中で高まっている一方で、日本は出遅れているといった声が多い。背景の一つに、基本特許が米国の研究者、大学、研究機関などに握られていることに加えて、紛争が続いていることがある。一方で、今やゲノム編集のメッカとも呼ばれる米ボストンでは、毎週のようにゲノム編集ベンチャーが立ち上がっている。日本企業としてはどこの企業とラインセンスを結べばいいのか悩むところだろう。
それに対して濡木氏は「基本特許だけでは事業化はできません。特にCas9はまだ発展途上の技術で、先ほどお話ししたような小型化やウイルスベクターの問題など解決しなければならない課題が数多くあります。実はこれらの周辺の技術については日本の方が研究が進んでいます。また、私たちのミニCas9は従来のCas9とはメカニズムが異なるので、既存の特許に抵触しない可能性もあります」
さらに、米国の研究者などが持つ基本特許があと10年ほどで切れるというのも日本企業にとっては有利だ。
「医療応用、産業応用を目指して、日本の製薬企業などもそろそろ検討を始めていい時期にさしかかっています。創薬における産学連携と言うと、どうしても医学部をイメージする企業が多いのですが、理学系研究科であっても本学では、クライオ電子顕微鏡による構造解析を行うなど、創薬の新しいアプローチに積極的に取り組んでいます。ぜひご協力をいただき、一緒に『日本発』の新しい医薬品、新しい医療を生み出してほしいと願っています」と濡木氏は力を込める。

<PR>