黒川清・日本医療政策機構代表理事監修
イモリのシッポや手を切っても、いずれきれいに再生する。これを応用したものが再生医療である。
2013年2月23日の英エコノミスト(The Economist)誌においても、「The best market in the world right now」、つまり日本は世界でもっとも有望なマーケットであり、再生医療のフィールドは、それを象徴するものとして大きく取り上げられている。
そのような中、今年11月、改正薬事法と再生医療新法(再生医療等の安全性の確保等に関する法律)がセットで成立、我が国の再生医療の制度が改定された。
筆者は、海外から多くの問い合わせに応え、ハーバード大学や米国NIH(国立衛生研究所)、IOM(米国医学研究所)、NAS(米国科学アカデミー)において新しい制度の紹介を行ってきた。ここでは、我が国の再生医療を担う新たな制度を解説したい。
改正薬事法のインパクトとは?
薬事法とは、医薬品や医療機器等の安全性、有効性等を担保する法律である。この改正薬事法のどこが世界的インパクトであるのだろうか?
通常、1つの医薬品を世に出すためには、薬事法に則った承認のプロセスが必要となる。承認を得るためには、多くの臨床試験(治験)が行われ、10年以上の年月がかかることは珍しくない。
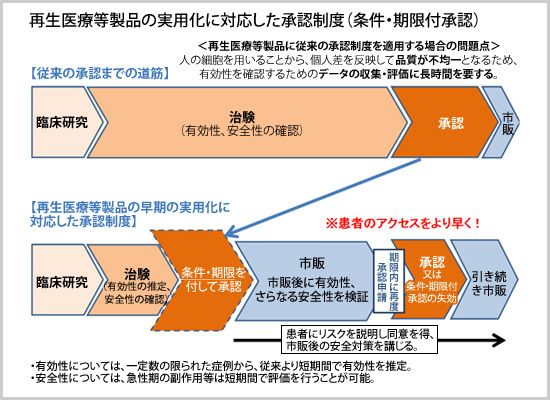
全く新しい治療技術である再生医療については、従来の医薬品の承認のプロセスをそのまま適用することができないため、あらたに承認のプロセスを確立し制度化する必要があった。
改正薬事法では、新たに「再生医療等製品」というカテゴリーが創設され、再生医療等製品に特化した新しい承認制度が確立される。なお、「等」には遺伝子治療製品や細胞を用いたがん免疫療法製品が含まれる。
また、それが新しい技術であることから、再生医療の安全性の確認には、これまでの経験が蓄積された通常の医薬品よりも、長時間を要するのが世界的な傾向である。
今回の薬事法改正により、必要とする再生医療への患者のアクセスをより早くすることが可能となり、有効性の判断については一定数の限られた症例から従来より短期間で有効性を推定することとし、安全性については急性期の副作用等は短期間で評価を行うことが可能とされ、これらにより、よりスピーディーな実用化が可能になるとされているため、世界の注目を集めているのである。