本記事は1月8日付フィスコ企業調査レポート(スリー・ディー・マトリックス)を転載したものです。
執筆 客員アナリスト 佐藤 譲
本資料のご利用については、必ず記事末の重要事項(ディスクレーマー)をお読みください。当該情報に基づく損害について株式会社日本ビジネスプレスは一切の責任を負いません。
止血剤の海外展開による拡大は不変、CEマーキングを用いたグローバル展開へ
スリー・ディー・マトリックス<7777>は2004年設立のバイオマテリアル(医療用材料)のベンチャー企業。米マサチューセッツ工科大学(MIT)で開発された「自己組織化ペプチド技術」の「独占的・全世界的な事業化権」を保有。同技術を基盤として外科医療領域、再生医療領域、DDS(ドラッグデリバリーシステム:体内の薬物分布を量的・空間的・時間的にコントロールする薬物伝達システム)領域での医療機器及び医薬品の開発を進めている。
2015年4月期の第2四半期(2014年8月-10月)における開発パイプラインの進捗状況を見ると、吸収性局所止血材(TDM-621)(以下、止血材)の臨床使用がドイツやイギリスなどEU各国、香港、チリなどの有力医療施設に広がっており、KOL(Key Opinion Leader :キーオピニオンリーダーとなる医者や有力医療施設など)から高い評価を受けたこと、また、粘膜隆起材(TDM-641)は国内での治験計画届を提出し、12月から治験を開始したこと、創傷治癒材(TDM-511)では米国食品医薬品局(以下、FDA)へ510(k)(医療機器の安全性及び有効性を証明する届出・承認申請)の申請を行ったこと、などが挙げられる。売上高の計上を伴うイベントがなかったため、第2四半期累計の損益は、事業費用1,004百万円がそのまま営業損失となった。
止血材に関しては、2015年4月期中に欧州での販売契約締結を目指す。一方、国内では独立行政法人医薬品医療機器総合機構(以下、PMDA)との協議が3年を超え長期化の様相を呈していたが、承認取得に向けた方策として、追加の治験を行うことの検討を始めた。仮に、治験の実施が決定すれば2015年4月期中の製造販売承認がなくなり、国内のマイルストーン収益と製品売上高について計画から外れることになるが、販売承認を得るための具体的なアクションが示されたことは前向きに評価されよう。その他のパイプラインでは米国での事業化を進めている歯槽骨再建材の第2段階目の治験が、2015年4月期中には開始される見込みとなっている。また、2015年4月期中の米国での止血材の治験開始や創傷治癒材の510(k)での承認取得を目指している。
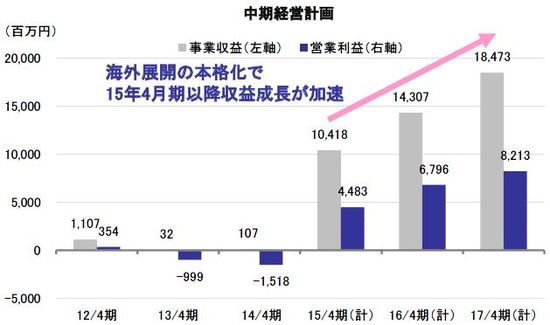
2015年4月期の連結業績は売上高10,418百万円、営業利益4,483百万円を計画しているが、これらイベントが予定どおり進捗することが前提となっている。国内止血材関連に関しては下振れ要因となる可能性が高いものの、中期的に見れば各パイプラインともに事業化に向けた動きが着々と進んでおり、2015年4月期以降、収益が成長ステージに入るという見方に変わりない。
Check Point
●止血材は国内でより精度の高い臨床試験の追加実施も検討
●2Qは訴訟和解金に関する特損160百万円を計上、今後のリスクは解消
●止血材市場は世界で30億ドル規模、同社製品の優位性高くシェア開拓余地
主要パイプラインの動向
止血材は国内でより精度の高い臨床試験の追加実施も検討、海外で着実に進展
(1)吸収性局所止血材
止血材(TDM-621)の進捗に関して、国内では製造販売承認に向けたPMDAとの協議が継続している。2011年5月に承認申請を提出して、既に3年を超え、長期化の様相を呈している。安全性に関しては問題ない様子であるが、治験データに基づく有効性の適正に関する協議が平行線をたどっている。症例の選び方やその評価に関してPMDAとの間に認識の相違があるようだ。このため、同社では承認取得に向け複数の方策を立てているが、そのなかの1つとして、より精度の高い臨床試験を追加で実施するという案を検討し始めている。










